- 联系人 : 封女士
- 联系电话 : 15057010416
- 移动电话 : 15057010416
- QQ : 2880725808
**荧光应用-巨噬细胞在ibidi腔室/通道载玻片中的培养处理
1. 基本信息
下面的应用描述了小鼠巨噬细胞系RAW-264.7(生物**等级2)在ibidi µ-Slides VI 0.4 和8孔腔室载玻片的培养方案。这是一个特殊的细胞系的例子,用于显示粘附时间,细胞密度和细胞形态的示范。本应用可根据您的具体实验要求进行调整。
2. 材料
在设置中应用下列材料:
·RAW-264.7 (murine macrophages, CLS - Cell Lines Service, Biosafety Level 2)
·Medium: RPMI 1640 with 2 mM L-Glutamin and 10% FBS
·µ-Slide VI 0.4, ibiTreat (ibidi 80606)
·µ-Slide 8 well, ibiTreat (ibidi 80826)
·Accutase (PAA Laboratories GmbH)
·1x Phosphate buffered saline (PBS)
3. 细胞培养与材料制备
在将细胞接种到玻片中之前,按照常规的方法培养细胞。
µ-Slide VI 0.4 :通道玻片和培养基,在37℃和5%CO2培养箱中培养过夜。这对于避免随着时间的推移出现气泡至关重要。为此,在50 ml器中填充适量的培养基,并轻轻地将瓶盖拧紧。在 µ-Slide 8孔载玻片开放孔井中,气泡可排出到大气中。
拆开µ-Slide的包装,把它放在µ-Slide支架上,并在准备细胞悬浮液时同时将盖子放在 Luer 适配器/孔上。
4. 播种细胞
分离细胞:
吸出培养瓶中的培养基,并用PBS洗涤细胞一次。每75cm² 烧瓶中加入3-5 ml的Accutase,并将烧瓶放入培养箱中以加快分离速度。如果是RAW-264.7细胞系,则大约需要8分钟。使用Accutase分离的细胞存活率更高。
4.1. 将细胞接种到µ-Slide VI 0.4中
在µ-Slide VI 0.4建议的细胞浓度:*终细胞数 0.3 x 10 5 cells/cm²,制备浓度6 x 10 5cells/ml。通过将移液器**直接放在通道的入口上,将30 µl细胞悬浮液填充到每个通道中。将盖子盖在玻片上,在37°C和5%CO2下孵育半小时以固定细胞。
细胞贴壁后,分别用60 µl无细胞培养基填充储液池。 避免将移液器吸头直接指向通道的入口。将玻片放回培养箱中。
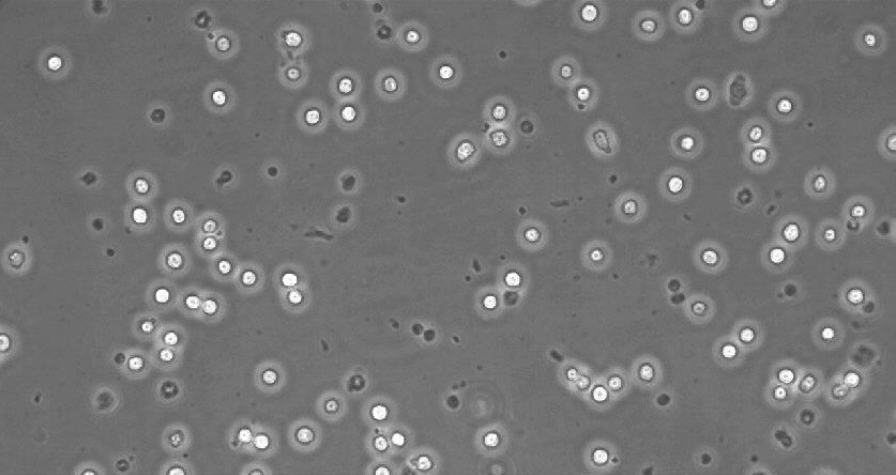
图1:接种后一小时,在ibiTreat µ-Slide VI 0.4(货号80606)中的RAW-264.7
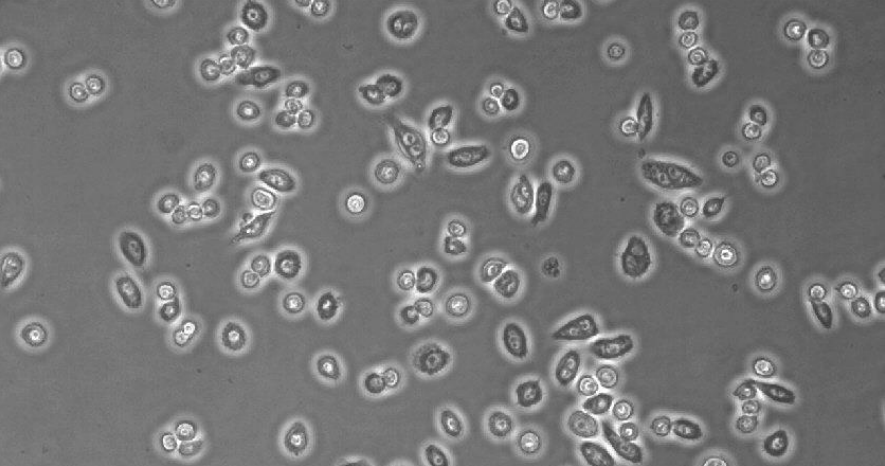
图2: 在ibiTreat µ-Slide VI 0.4中的RAW-264.7,孵育24小时后
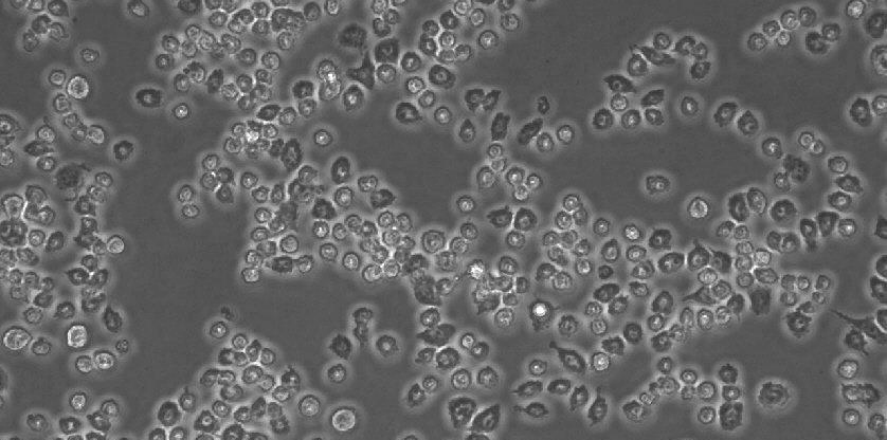
图3:在ibiTreat µ-Slide VI0.4中的RAW-264.7,培养四天后
4.2 将细胞播种在µ-Slide 8 well 中
在µ-Slide 8 well建议的细胞浓度:*终细胞数 0.3 x 10 5 cells/cm² ,制备浓度 1.1 x 10 5 cells/ml。将300 µl 的细胞悬浮液注入各孔中。将盖子盖在玻片上,在37°C和5% CO2中孵育。不需要进一步添加培养基。
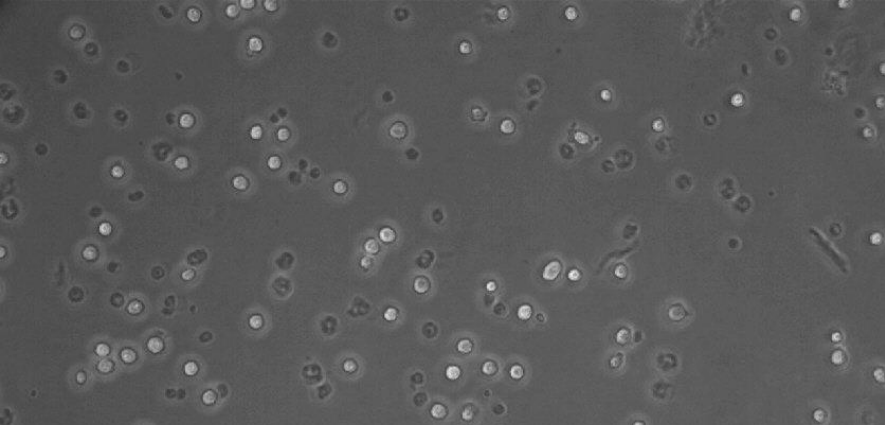
图4:在ibiTreat µ-Slide 8 well(货号:80826)中的RAW-264.7,播种后1小时
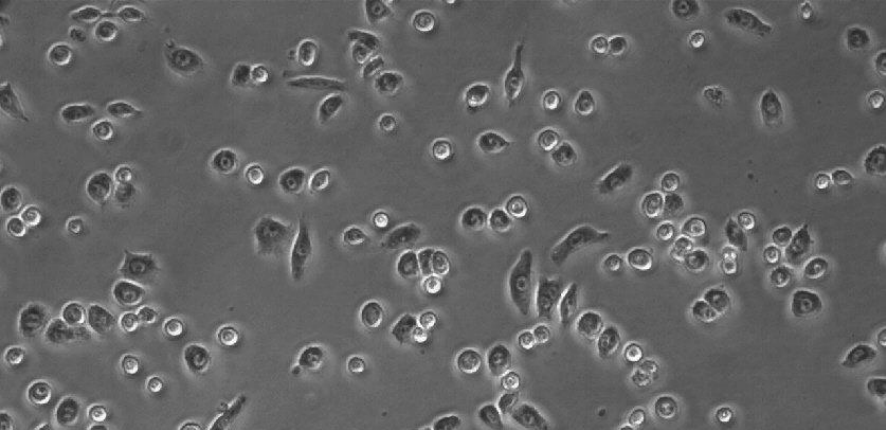
图5: 在ibiTreat µ-Slide 8 well中的RAW-264.7,孵育24小时后
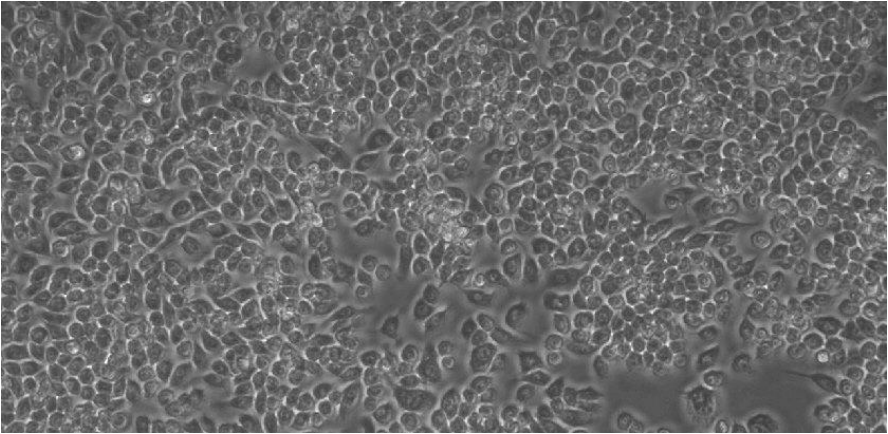
图6:在ibiTreat µ-Slide 8 well中的RAW-264.7,经过四天的培养
为获得*佳的分布的匀的细胞,我们建议使用像µ-Slide VI 0.4 这样的通道载玻片。在8孔腔室载玻片中,细胞密度可能会在孔的整个表面上因点而异,具体取决于细胞播种过程中的处理。
5. **荧光染色
像往常一样为您的细胞固定和染色。
注意:在 µ-Slides 中染色时注意液体的处理
µ-Slide VI 0.4 :更换液体,先吸出两个储液池而不排空通道。 如果您使用的是真空设备,请注意不要将吸头直接放在通道的入口上。 用100 µl新溶液冲洗通道3次。 从一侧添加新的溶液,通过通道流入另一个储液池,然后从另一侧吸出,直到两个储液池都排空。注意通道永远不要干涸!
µ-Slide 8孔载玻片:在 µ-Slide 8孔中,无需特殊处理措施。像在任何其他培养皿或孔板中一样的交换液体。
下文中,给出了使用以下材料对细胞核和肌动蛋白丝进行染色的示例:
细胞核:DAPI(Diamidino pheylindol dihydrochlorid) SIGMA, 32670
肌动蛋白丝:Phalloidin, Alexa Fluor ® 488 Conjugate, LONZA, PA-3010
1. 用3.7% 的PFA在PBS(pH 7.4)中室温下固定细胞10分钟。
2. 用PBS清洗细胞三次。
3. 用Triton X 100(0.1%)孵育细胞5分钟。
4. 用PBS清洗细胞三次。
5. 用1%牛血清白蛋白在PBS中孵育20分钟。
6. 用PBS清洗细胞三次。
7. 在0.2μm浓度下用鬼笔环肽Alexa For 488孵育细胞20分钟。
8. 用PBS清洗细胞三次。
9. 用DAPI(0.5μg/ml)孵育细胞10分钟。
10. 用PBS清洗细胞三次。
11. 完全吸出通道并用ibidi封片剂重新填充。 现在样品可在显微镜上观察了。保存在阴暗阴凉处可储存数周。
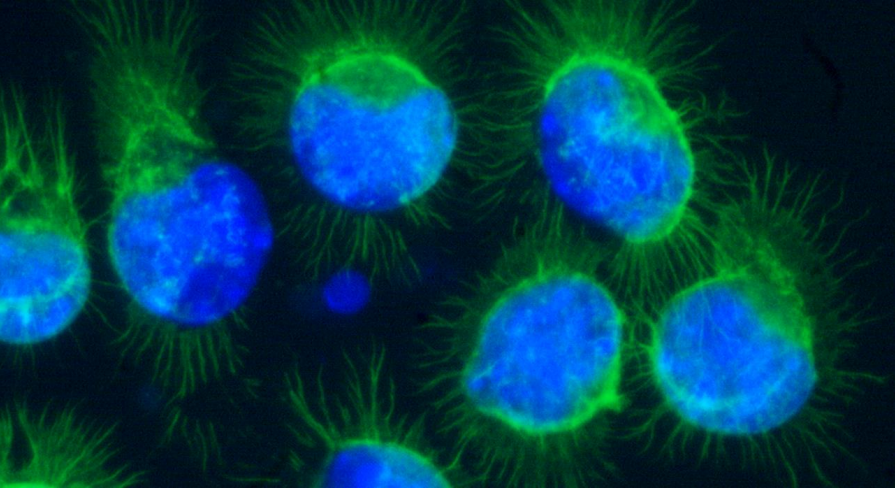
图7:在 µ-Slide VI 0.4中的RAW-264.7用DAPI(细胞核、蓝色)和Phalloidin, Alexa Fluor ® 488 Conjugate(肌动蛋白丝,绿色)


